東京大学医科学研究所教授 河岡義裕氏 ロングインタビュー 前編 ウイルスの変異を高精度で予測 −−より有効なワクチン開発に道
河岡 義裕
Author Interview
2016年6月号、2016年8月号掲載
インフルエンザウイルスを人工的に合成するなど世界的に業績を知られる東京大学医科学研究所河岡義裕教授。このほど、インフルエンザウイルスの抗原変異を高い精度で予測する技術の開発と、宿主の核内におけるウイルスの動態に寄与するタンパク質の同定に関する2つの研究成果を、Nature Microbiology に発表した。ともにワクチン、治療薬の開発に道を開くもので、特に抗原変異の予測はより有効なワクチン製造を可能にする画期的な成果であり、すでに実用化に向け応用が始まりつつある。今回、これら2つの成果を踏まえ、パンデミックへの危機感と研究の重要性、デュアルユース(科学研究の両義性)、社会とのかかわり、今後の研究の方向性について河岡教授に聞いた。前編、後編に分けてお届けする。
―― まず、季節性インフルの抗原変異株が今までより高い精度で予測できるということから伺います。
河岡氏: ご存知のとおり、インフルエンザウイルスは絶えず変異するので、頻繁に異なる株のワクチンを作らなくてはいけません。北半球では2月に、各国の世界保健機関(WHO)協力センターの専門家が9月〜1月(場合によっては2月)までの世界各地の流行株のデータを持ち寄り、次のシーズンにどんなウイルスが流行するかワクチン株を選定・推奨しています。日本では、それを持ち帰って感染症研究所が日本の情報をもとに4月までに流行株を予想し、製造にかかります。ワクチン株と流行株の抗原が一致すれば、一般的には70%の人に効果があると言われますが、時々、ワクチン株の予想が外れてワクチンが効かず、インフルエンザが大流行する年があります。例えば2014-15年のシーズンで、アメリカのワクチン株はその抗原性は流行株とは異なっていたため、ワクチンの有効性は23%しかありませんでした。ウイルスの抗原がどのように変化するのか、これを事前に先回りして予測できないかと4年ほど前から研究を始めました。
―― 抗原変異とワクチンの関係をご説明いただけますか。
河岡氏: 抗原とは、ウイルスが体内に侵入した時、ヒトの免疫が「外敵だ。退治せよ」と、認識する物質です。インフルエンザウイルスの場合、主要抗原はウイルス表面にあるとげ状のタンパク質「ヘマグルチオン(HA)」です。ワクチンは、このHAがどのように変異するのかを予想し、その抗原を持ったウイルス株を決めて、製造されます。流行前に、ワクチンを皮下または筋肉内に注射すると、血液中に予想されたウイルス株を攻撃する中和抗体が産生されます。このワクチン株の予想が当たれば、流行期に感染してもインフルエンザの発症や重症化を防ぐことにつながります。
―― HAはなぜ変異するのでしょうか。
河岡氏: ヒトのインフルエンザウイルスは伝播力が強く、新たなウイルスが世界中に広がり、世界中の人がそのウイルスに対し免疫を持つようになります。一方、インフルエンザウイルスは変異しやすいため、その免疫を逃れる変異ウイルスが現れ、それが新たに世界中に広がります。このようにして、季節性インフルエンザウイルスは、HAの抗原性が少しずつ変異することによりヒトからヒトへと感染していくのです。
―― パンデミックとはどこが違うのですか。
河岡氏: 1997年以降、鳥インフルエンザの拡大が話題となっています。これは鳥のウイルスの遺伝子が変異して、ヒトで伝播する能力を獲得する可能性があったからです。動物を経てヒトに感染し、これがヒトからヒトへと拡大するとパンデミックになります。1968年に世界的に流行した「香港風邪(A/H3N2)」、2009年の「2009年新型インフルエンザ(A/H1N1pdm)」などがあります。インフルエンザウイルスには、HAのほかに、NA(ノイラミニダーゼ)タンパク質などを作るための8つの遺伝子があります。パンデミックを起こすウイルスは、それまでヒトでは流行していないウイルスの遺伝子、特にHAを持っています。パンデミックウイルスは、多くのヒトが感染してしまうと、数年後には季節性インフルエンザウイルスとしてマイナーチェンジを繰り返しながら流行を続けます。
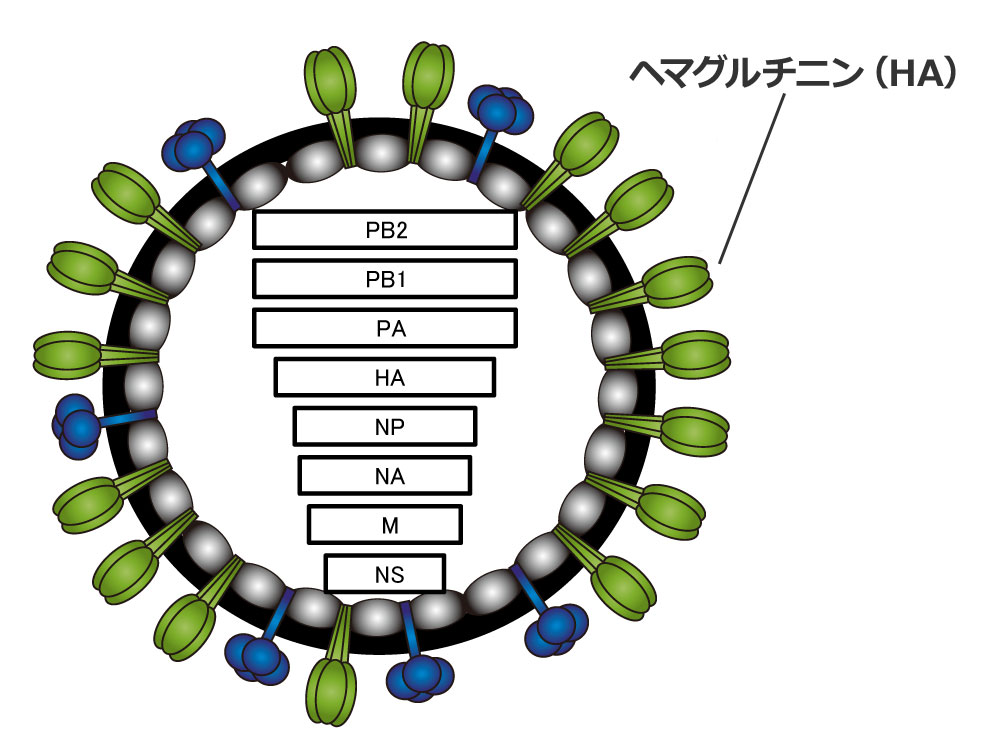
インフルエンザウイルスは8本の遺伝子をもち、ウイルスの主要抗原であるヘマグルチニン(HA)に覆われている。 | 拡大する
―― このマイナーチェンジ、HAの変異を予測したのが今回の成果ですね。決めては何だったのでしょうか?
河岡氏: 1つのカギは、1999年に我々が開発した「リバースジェネティクス法」です。これは、先ほどお話したウイルスの8つの遺伝子を発現する8本のプラスミド、4つのウイルスタンパク質を発現する4本のプラスミドを細胞に導入すると、感染性を有するウイルスを産生することができるという方法です。この手法を2009年のパンデミックウイルス「A/H1N1pdm」に応用し、ランダムに変異させたHA遺伝子を持つウイルスライブラリーを作りました。これをA/H1N1pdmに感染したヒトや動物から採取した血清と混ぜます。血清の中には、A/H1N1pdmに対する抗体があるので、変異していないウイルスは中和され、変異しているウイルスだけが残るわけです。
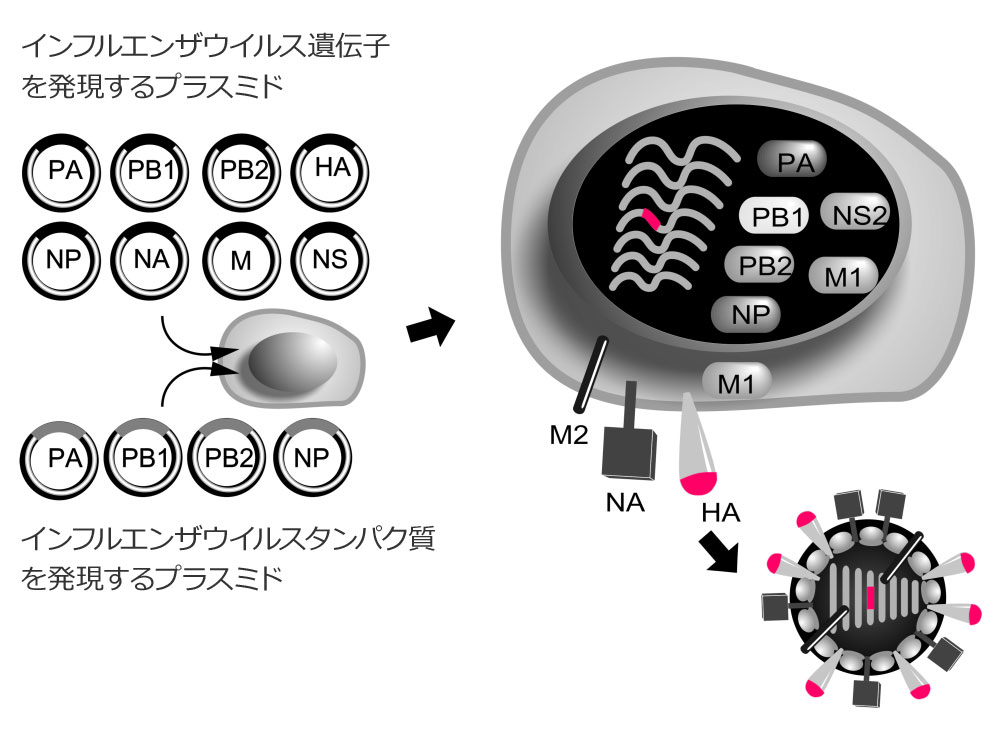
8本のウイルス遺伝子を発現するプラスミドと4本のウイルスタンパク質を発現するプラスミドを細胞に導入すると感染性を有するウイルスを産生させることができる。プラスミドは簡単に変異を導入することが可能なため、自由に人工的に変異を持つウイルスを作出することが可能である。 | 拡大する
―― 変異したウイルスにはどんな特徴がありますか。
河岡氏: 変異株を調べたところ、HAの抗原決定領域に複数変異があることがわかりました。抗原決定領域とは、抗体が認識して結合する部位ですが、ここが変異して抗体が認識できなくなったというわけです。これは赤血球凝集抑制(HI)試験によって視覚化できます。ウイルスが増えると赤血球どうしがウイルスを介してくっつき、肉眼でも確認できるほど集まって塊ができます。変異株では、中和抗体があってもこの凝集塊ができたということです。通常、抗体がウイルスに結合すると、赤血球とウイルスは結合せず、赤血球の凝集塊もできません。これが赤血球凝集抑制反応です。つまり変異株は凝集抑制されなかったのです。さらに、この変異株にはどんな特徴があるのか、抗原性を二次元の地図に展開して調べると、どのような傾向があるのかを明らかにすることができます。この解析により、ウイルスがどういう方向に変異していくのかが読み取れるというわけです。
季節性インフルエンザウイルスの感染者あるいは感染動物から採取した血清とウイルスライブラリーを混合した後、培養細胞に接種して、増えてきた変異株を回収した。また、ウイルスを免疫したマウスにウイルスライブラリーを感染させて、増えてきた変異株を回収した。回収した変異株の抗原性を、赤血球凝集抑制試験と抗原地図法で分析した。 | 拡大する
―― こうした現象は実際、自然界でも起こるのでしょうか。
河岡氏: その証明がもう1つのカギです。今回我々が見つけた変異株(「16-1/4変異株」と命名)が自然界で流行するか検証するため、2009年にヒトから採取したA/H1N1pdmの流行株(CA04株と命名)に対する抗体を持つフェレットに、16-1/4変異株あるいはCA04株を感染させたのです。CA04株を接種したほうは、すでに存在する中和抗体のため、ウイルスは全く増殖しませんでした。一方、16-1/4変異株は増殖しました。これは、今後自然界で、16-1/4株のような変異を持つA/H1N1pdmが流行することを示しています。実際、2013-2014年に流行した香港型A/H3N2ウイルスの抗原の変異をこの手法で予測したものは、2014-2015年に流行したウイルスの抗原性と一致しました。つまり、実際にインフルエンザ流行期に起きた抗原変異を事前に予測することに成功したことになります。
流行株のCA04株をフェレットに感染させた。12ヶ月後、フェレットがCA04株に対する抗体を保有しているのを確認した後、CA04株あるいは16-1/4変異株を再び感染させた。CA04株感染群からはウイルスは全く検出されなかったが、16-1/4変異株感染群からは大量のウイルスが検出された。 | 拡大する
―― ワクチン製造への応用は始まっているのですか。
河岡氏: ワクチンは基本的に4つのウイルス株が含まれています。A型インフルエンザウイルスのH1N1、H3N2とB型の2つで、どのような株を選ぶかはWHOの会議で決まります。我々の手法を使えば、A型ウイルスの予測精度が高まるので、従来以上に効果の高いワクチン製造が期待できることになります。すでに、WHOの会議に向け、その準備は始まっています。来年以降のワクチン製造には我々の手法が応用されるかもしれません。今後は、5年程度でB型ウイルスの変異を予測する技術も開発していきたいと思います。
―― 予測精度を高めるには?
河岡氏: ウイルスの抗原変異は、クラスターとなってある一定の方向に進化していくことがわかってきました。これを遺伝子解析などと合わせてバイオインフォマティクスの手法を駆使することにより予測できるのではないかと思っています。データの蓄積を重ねて、実用化したいですね。
―― もう1つの研究成果についてもお聞きします。
河岡氏: インフルエンザウイルスは感染した際、宿主側のヒト、動物のタンパク質を利用して複製・増幅することが知られています。治療法、予防法を探る意味で重要です。今回はその宿主側のタンパク質の1つ「CLUH」がウイルス増殖過程で、ウイルスゲノムの核内輸送に関与しているということを発見しました。まだ基礎研究ですぐに治療に結びつくというものではありませんが、こうした基礎研究が将来のブレークスルーにつながるのでとても大事な研究です。
―― 簡単に成果、意味づけをご説明ください。
河岡氏: ウイルスのゲノムRNA(vRNA)は感染した細胞の核内で、ウイルスのタンパク質PB2、PB1、PA、NPとvRNPと呼ばれる複合体を作ります。このvRNPは、宿主の核外輸送タンパク質に結合して核外に輸送されることがわかっています。しかし、核内でどう動いているのか、何が起きているのか不明でした。今回の成果は、本来、核外の細胞質にあるCLUHが、ウイルスのタンパク質PB2と結合することで核内に移動し、さらにウイルスのタンパク質M1と結合すると核内の特定の領域に移動することがわかりました。このPB2とM1が存在する中で、CLUHがvRNPを核外輸送体まで移動させることに関与している可能性が示唆されました。しかし、なぜインフルエンザウイルスのゲノムが核内で複製されるのか、不明な点が多いのです。宿主内では多くのタンパク質が何らかのウイルス複製・増殖にかかわっていますが、まだ全体像はわかっていません。しかし、ウイルスの増殖のメカニズムを明らかにする研究は抗ウイルス薬の開発をする上で重要です。
―― ありがとうございました。
後編に続く。
聞き手 玉村治(科学ジャーナリスト)。
聞き手 玉村治(科学ジャーナリスト)。
Nature Microbiology 掲載論文
Article: 季節性インフルエンザウイルスの抗原変異株の予測選定
Nature Microbiology 1 : 16058 doi:10.1038/nmicrobiol.2016.58 | Published online 23 May 2016
Article: 宿主タンパク質CLUHはインフルエンザウイルスのリボ核タンパク質複合体の核内輸送にかかわっている
Nature Microbiology 1 : 16062 doi:10.1038/nmicrobiol.2016.62 | Published online 16 May 2016
Author Profile
河岡 義裕(かわおか よしひろ)
東京大学医科学研究所感染・免疫部門ウイルス感染分野 教授
米国ウィスコンシン大学マディソン校獣医学部 教授
米国ウィスコンシン大学マディソン校獣医学部 教授
| 1978年 | 北海道大学獣医学部卒業 獣医師免許取得 |
| 1980年 | 同大大学院博士課程修了 鳥取大学農学部獣医微生物学講座 助手 |
| 1983年 | 獣医学博士(北海道大学)取得 聖ジュード小児研究病院(米国)にてポスドクとして従事 |
| 1985年 | 同病院 助教授研究員 |
| 1989年 | 同病院 准教授研究員 |
| 1996年 | 同病院 教授研究員 |
| 1997年 | ウィスコンシン大学マディソン校獣医学部 教授(現職) |
| 1999年 | 東京大学医科学研究所細菌感染研究部 教授 |
| 2000年 | 同研究所感染・免疫部門ウイルス感染研究分野 教授(現職) |
| 2005年 | 同研究所感染症国際研究センター長 |
野口英世記念医学賞(2002年)、文科大臣表彰科学技術賞(2006年)、ロベルトコッホ賞(同)、日本農学賞・読売農学賞(2010年)など受賞。2011年紫綬褒章受章。2016年日本学士院賞受賞。2013年には米国科学アカデミー外国人会員となる。





0 Comments:
コメントを投稿
<< Home